El descubrimiento de gran cantidad de productos naturales; principalmente metabolitos secundarios de origen marino, conteniendo uno o más sub-unidades de oxazoles, así como también, el uso de bis-oxazolinas como auxiliares en síntesis estereocontroladas,[1] ha estimulado a una gran cantidad de químicos orgánicos a retomar investigaciones tendientes a lograr nuevos y mejores métodos para la síntesis de estos heterociclos, especialmente aquellos que resultan estar 2,4-disustituidos.[2] Saludos Marcelo
No existe un único método sintético para la construcción de éstas unidades, presentando cada uno de ellos sus ventajas así como también sus limitaciones. En los últimos años la ciclación de b-hidroxiamidas (en mucos casos mimetizando la biosíntesis de estos sistemas) ha sido objeto de intensos estudios, al punto tal que, resulta ser una de las más vías sintéticas más utilizadas hoy en día para la construcción de este tipo de anillos 2,4-disustituidos.[3]
Las b-hidroxiamidas pueden ser preparadas fácilmente a través de metodologías clásicas de amidación a partir de los correspondientes ácidos, aminoalcoholes, y diferentes reactivos de acoplamiento. A punto de partida de las correspondientes b-hidroxiamidas, una secuencia de ciclodeshidratación y posterior oxidación nos conduce al sistema oxazólico. Esta secuencia puede ser realizada en dos pasos sintéticos, aislando la oxazolina intermediaria o bien en una sola etapa.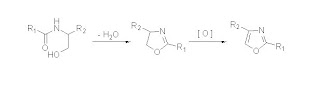 Se describen en la literatura numerosos procedimientos para la ciclación de b-hidroxiamidas. Todos ellos centrados, fundamentalmente, en la búsqueda de condiciones de reacción más suaves, las cuales resulten a su vez compatibles con la presencia de otros grupos funcionales presentes en la molécula, y por otro lado que eviten la epimerización de centros quirales en aquellos compuestos que los contienen.
Se describen en la literatura numerosos procedimientos para la ciclación de b-hidroxiamidas. Todos ellos centrados, fundamentalmente, en la búsqueda de condiciones de reacción más suaves, las cuales resulten a su vez compatibles con la presencia de otros grupos funcionales presentes en la molécula, y por otro lado que eviten la epimerización de centros quirales en aquellos compuestos que los contienen.
Las metodologías de ciclodeshidratación más utilizadas involucran el uso de reactivo de Burgess, SOCl2, derivatizaciones del hidroxilo en b para transformarlo en un buen grupo saliente (como por ejemplo formación de mesilatos sobre los mismos), ciclaciones utilizando condiciones de Mitsunobu, utilización de trifluoruro de dietilaminosulfuro (DAST) y trifluoruro de bis(2-metoxietil)aminosulfuro (Deoxo-Flúor), entre otros. Mecanisticamente todas transcurren vía una sustitución nucleofílica intramolecular del átomo de oxígeno de la amida (trabajando en su forma enamínica) sobre el grupo hidroxilo activado. Una metodología clásica para llevar a cabo la ciclodeshidratación es el uso de SOCl2 para la obtención de oxazolinas 2,4-disustituidas.[4] El primer intermediario que se forma es la b-cloroamida la cual requiere tratamiento bajo condiciones básicas para que se complete la ciclación a oxazolina. La utilización de este reactivo ha sido muy aplicada en la obtención de bis(oxazolinas) quirales,[5] las mismas poseen un carbono asimétrico en posición 4 y se utilizan como ligandos quirales en síntesis asimétrica. Cabe destacar que se han reportado casos de racemización, como el encontrado por Node y colaboradores en la síntesis total de Micestericina,[6] así como también casos de deshidratación del alcohol primario debido a las condiciones fuertes de reacción. Al mismo tiempo este procedimiento en muchos casos no resulta fácilmente reproducible y transcurre con bajos rendimientos.
Una metodología clásica para llevar a cabo la ciclodeshidratación es el uso de SOCl2 para la obtención de oxazolinas 2,4-disustituidas.[4] El primer intermediario que se forma es la b-cloroamida la cual requiere tratamiento bajo condiciones básicas para que se complete la ciclación a oxazolina. La utilización de este reactivo ha sido muy aplicada en la obtención de bis(oxazolinas) quirales,[5] las mismas poseen un carbono asimétrico en posición 4 y se utilizan como ligandos quirales en síntesis asimétrica. Cabe destacar que se han reportado casos de racemización, como el encontrado por Node y colaboradores en la síntesis total de Micestericina,[6] así como también casos de deshidratación del alcohol primario debido a las condiciones fuertes de reacción. Al mismo tiempo este procedimiento en muchos casos no resulta fácilmente reproducible y transcurre con bajos rendimientos.
El reactivo de Burguess [CH3O2CNSO2(C2H5)3] también ha sido muy utilizado para efectuar esta metodología de ciclodeshidratación.[7] La ventaja más importante radica en las condiciones neutras y más suaves en las cuales se realiza la reacción. El uso de este reactivo se reporta como superior a otras metodologías, como ser aquellas que utilizan PPh3/CCl4/MeCN o MsCl/Et3N/CH2Cl2. Una variante de este reactivo, ha sido desarrollada por parte del grupo del profesor Peter Wipf de la Universdad de Pittsburg. La misma consiste en unir el reactivo de Burguess a polietilenglicol, este reactivo se conoce en la literatura como Burguess-PEG.[8] De esta manera se obtiene un reactivo más estable y de mejor eficacia para la activación del grupo hidroxilo. Sumado a esto este reactivo agrega otras ventajas como ser: un “work-up” de reacción mucho más sencillo, así como también un bajo porcentaje de epimerización [9]. El inconveniente más notorio de esta metodología, es el uso de condiciones básicas de reacción así como también la necesidad de altas temperaturas (incluso reflujo) para que tenga lugar la ciclación. En algunos ejemplos reportados en la literatura, se da cuenta también de la formación del acrilato correspondiente como producto secundario en porcentajes mayores al 20%, consecuencia directa de la existencia de reacciones de b-eliminación bajo estas condiciones.
Otra de las metodologías clásicas para la preparación de oxazolinas es el uso de la reacción de Mitsunobu (Ph3P, Et2OC=CO2Et).[10] Surge como alternativa al uso del reactivo de Burguess y su utilización está muy condicionada a las posibles conformaciones que pueda adoptar hidroxilo activado.
Por último el uso de reactivos como DAST[11] [(CH2H5)2NSF3] y Deoxo-Flúor[12] [(CH3OCH2CH2)2NSF3] a bajas temperaturas, han sido muy utilizados en la última década para la síntesis de oxazolinas y tiazolinas. Ambos son compatibles con un rango muy amplio de grupos funcionales, dan reacciones muy limpias, conservación de la estereoquímica (existen excepciones para el caso de DAST19) y muy buenos rendimientos. El uso del Deoxo-Flúor fue reportado por primera vez en el año 2000 por Williams, Wipf y colaboradores como alternativa al uso de DAST. Tiene la ventaja sobre el DAST de ser térmicamente más estable, y al mismo tiempo no es necesaria la presencia de bases en el medio de reacción. Ambos reactivos tanto el DAST como el Deoxo-Flúor no conducen a compuestos secundarios fluorados, sin embargo en algunos casos con el uso del DAST se observaron procesos de deshidratación dando lugar al sistema α-β insaturado que disminuye mucho los rendimientos de reacción.
La aromatización de oxazolinas por medio de oxidaciones es otra de las metodologías que han despertado el interés de numerosos grupos de investigación en los últimos años. Las limitaciones de los métodos clásicos de oxidación, la necesidad de encontrar metodologías para deshidrogenar selectivamente sin afectar otros grupos funcionales, así como también la necesidad de aumentar rendimientos, ha sido el motor impulsor de las mismas.
Existen reportadas en la literatura diferentes metodologías de oxidación, las cuales si bien en algunos casos resultan generales, en otros son muy dependientes de las características del sustituyente en posición 4 del anillo.
Uno de los métodos más antiguos, y de mayor difusión, es la oxidación con NiO2.[13] Un ejemplo clásico del uso de este reactivo puede verse en la síntesis de Eupolauramina.[14] En la misma, la oxidación se realiza en benceno bajo condiciones de reflujo. Se propone para que esta reacción transcurra un mecanismo radicalario. Generalmente, para la obtención de buenos rendimientos es necesaria la presencia en posición 4 de un grupo atrayente de electrones como por ejemplo un grupo éster.
Otros óxidos metálicos tales como el MnO2 activado[15] se reportan habitualmente en la literatura para realizar este proceso de oxidación. Los rendimientos reportados son muy variables y oscilan entre 40 y 94%. Al mismo tiempo no existe una concordancia en los mecanismos involucrados en esta reacción, existiendo discrepancias entre muchos autores, alguno de los cuales sostienen que los mismos involucran especies iónicas mientras que otros proponen intermediarios radicalarios.
Paralelamente a la utilización de óxidos metálicos, algunos autores reportan la utilización de quinonas como la DDQ[16] como reactivos oxidantes frente a sistemas heterocíclicos de este tipo.
La utilización de N-bromosuccinimida (NBS) o NBS/AlBN[17] también está ampliamente reportada en la literatura como método de oxidación de heterociclos parcialmente insaturados.
Tal como se indicaba anteriormente la transformación de b-hidroxiamidas a los correspondientes oxazoles puede ser realizada en una secuencia por pasos con aislamiento de la oxazolina intermediaria o bien en una secuencia de reacción que transcurra en un solo paso. Es así que conjuntamente con el uso de Deoxo-Flúor como agente ciclodeshidratante aparece reportada en la literatura la oxidación con BrCCl3 y DBU en CH2Cl2 a 0 ºC en un proceso secuencial sin aislamiento de intermediarios.28,[18] Esta secuencio está reportada en la literatura con rendimientos que oscilan entre el 68 y el 95%. En esta metodología (donde no se evidencia la obtención de productos bromados los cuales resultarían debidos a una etapa inicial de bromación) resulta una herramienta sintética de gran utilidad para la síntesis de oxazoles C5 no-sustituidos. La limitante nuevamente de esta metodología es la necesidad de contar con un sustituyente atrayente de electrones en posición 4 del anillo. Pese a esto, esta reacción resulta ser un complemento ideal para la metodología de Dess-Martin periodinano-(I2/PPh3)[19] utilizada para la síntesis de oxazoles C5-sustituidos.
[1] Davison, B. Chem. Rev., 1993, 93, 1771.
[2] Turchi, I. “Oxazoles “, Jhon Wiley & Sons, Inc.; USA; 1986.
[3] Palmer, D. C. “Oxazoles: Synthesis, Reactions and Spectroscopy”, John Wiley & Sons, Inc.; USA; 2004.[4] a) Crawhall, J.; Elliot, D. J. Chem. Soc., 1951, 2070. b) Wipf, P.; Fritch, P. C. Tetrahedron Lett., 1994, 35, 5397. c) Denmark, S. E.; Nakajima, N.; Nicaise, O.; Faucher, A.; Edwards, J. P. J. Org. Chem., 1995, 60, 4884.
[5] Fahrni, C. J.; Pfaltz, A. Helv. Chim. Acta. 1998, 81, 491.
[6] a) Shibata, K.; Shingu, K.; Vassilev, V. P.; Nishide, K.; Fujita, T.; Node, M.; Kajimoto, T.; Wong, C. Tetrahedron Lett., 1996, 37, 2791. b) Nishide, K.; Shibata, K.; Fujita, T.; Kajimoto, T.; Wong, C.; Node, M. Heterocycles, 2000, 52, 1191.
[7] a) Burgess, E.; Penton, H.; Taylor, E. J. Org. Chem. 1973, 38, 26. b) Wipf, P.; Miller, C. J. Org. Chem., 1993, 58, 1575. c) Wipf, P.; Miller, C.; Venkatraman, S.; Fritch, P. Tetrahedron Lett. 1995, 36, 6395.
[8] Wipf, P.; Venkatraman, S. Tetrahedron Lett., 1996, 37, 4659.
[9] Boulch, R.; Scheurer, A.; Mosset, P.; Saalfrank, R. Tetrahedron Lett., 2000, 41, 1023.
[10] a) Galleotti, M.; Montagne, C.; Jouin, J. Tetrahedron Lett., 1992, 33, 2807. b) Wipf, P.; Miller, C. Tetrahedron Lett., 1992, 33, 6267.
[11] a) Burell, G.; Evans, J.; Jones G.; Stemp, G. Tetrehedron Lett., 1990, 31, 3649. b) Lafargue, P.; Guenot, P.; Lellouche, J. Synlett. 1995, 171.
[12] Phillips, A.; Uto, Y.; Wipf, P.; Reno, M.; Williams, D. Org. Lett., 2000, 2, 1165.
[13] Por una revisión del uso de NiO2 ver George, M.; Balachadran, S. Chem. Rev., 1975, 491.
[14] Levin, J.; Weinreb, S. J. Am. Chem. Soc., 1983, 105, 1397.
[15] Fukushima, K.; Lu, Y.; Ibata, T. Bull. Chem. Soc. Jpn., 1996, 69, 3289.
[16] a) Piozzi, F.; Venturella, P.; Bellino, A. Org. Prep. Proced. Int., 1971, 3, 223. b) Meyers, A.; Nolen, R.; Collington, E.; Narwid, T.; Strickland, R. J. Org. Chem. 1973, 38, 1974. c) Conley, R.; Heindel, N. J. Org. Chem. 1975, 40, 3169.
[17] Kashima, C.; Arao, H. Synthesis, 1989, 873.
[18] Williams, D.; Lowder, P.; Gu, Y.; Brooks, D. Tetrahedron Lett., 1997, 38, 331.
[19] Dess, D.; Martin, J. J. Am. Chem. Soc., 1991, 113, 7277.
I never quit
Hace 9 años




0 comentarios:
Publicar un comentario